Forschung
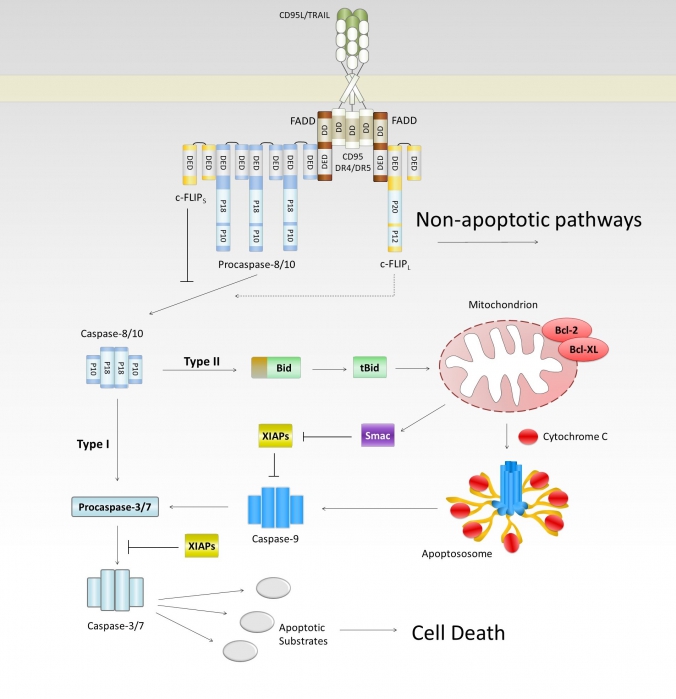
The research programme involves scientific projects on the regulation of apoptosis, inflammation and cancer. The central point of our investigations is the control of the cell death and switching between apoptotic and non-apoptotic phenotypes in the death receptor system. The special attention is given to the assembly and composition of protein complexes initiating apoptosis as well as to the role of posttranslational modifications in the regulation of death receptor signaling pathways. In addition, we are highly interested in the spatio-temporal control of the cell death events, which is approached by single cell analysis. Deregulation of apoptosis and inflammation is associated to a number of diseases, such as cancer and autoimmune disorders. Our research programme is also aimed at unraveling the defects in death receptor-mediated apoptosis and inflammation associated to with these diseases.
This might lead to the discovery of new targets based on death receptor pathways and provide an important basis for pharmaceutical drug development. Finally, we are very much involved in chemical biology and the rational design of the chemical tools.
Our research areas
- Understanding apoptosis regulation by systems biology
- Regulation of apoptotic and non-apoptotic signaling in the death receptor system
- Spatio-temporal control of death receptor signaling
- Control of the NF-kB system by death receptors
- Dynamics and function of death receptor networks - mathematical modeling/systems biology
- Rational design of chemical probes targeting key components of the death receptor system
Research projects
- Deciphering the molecular mechanisms of life/death decisions at CD95/Fas
- Developing new small molecules targeting the CD95 network
- Uncovering the role of posttranslational modifications in the regulation of death receptor signaling







